Лекция по теме "Органические вещества клетки"
Углеводы (сахара, сахариды). Углеводами называются органические соединения, состоящие из углерода, водорода и кислорода. Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира, составляя (по массе) основную часть органического вещества на Земле. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями. Углеводы составляют около 80 % сухой массы растений и 2—3 % массы животных
Cx(H2O)y
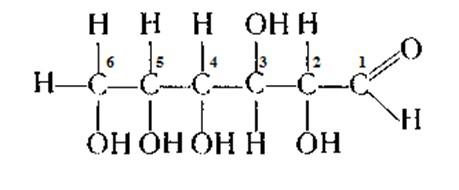


Простые и сложные
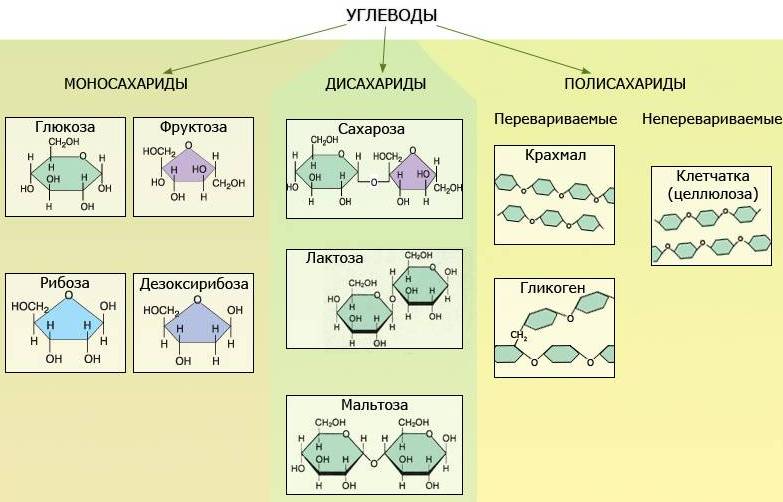
Углеводы состоят из отдельных «единиц», которыми являются сахариды. Углеводы, содержащие одну единицу, называются моносахариды, две единицы – дисахариды, от двух до десяти единиц — олигосахариды, а более десяти — полисахариды.
Моносахариды легко растворяются в воде и синтезируются в зелёных растениях. Обычно представляют собой бесцветные, твёрдые прозрачные органические соединения, одна из основных групп углеводов, самая простая форма сахара. Из моносахаридов синтезируются дисахариды, олигосахариды и полисахариды
Рибоза - С5Н10О5

Дезоксирибоза - С6Н10О4

В природе в свободном виде наиболее распространен
Глюкоза (виноградный сахар) С6Н12С6
Фруктоза изомер глюкозы С6Н12С6

Олигосахариды
Образованы двумя моносахаридами – дисахариды:
Сахароза (глюкоза + фруктоза)

Мальтоза (глюкоза + глюкоза)

Лактоза - изомер сахарозы

Дисахариды являются одним из основных источников углеводов в рационе человека и животных.
Общее название класса сложных углеводов - полисахариды, молекулы которых состоят из десятков, сотен моносахаридов.
Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Это один из основных источников энергии организма, образующейся в результате обмена веществ. Полисахариды принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.
Крахмал - (С6Н10О5)n

C6H10O5 - Белое аморфное вещество, не растворимое в холодной воде, способное к набуханию.
Гликоген - (С6Н10О5)n
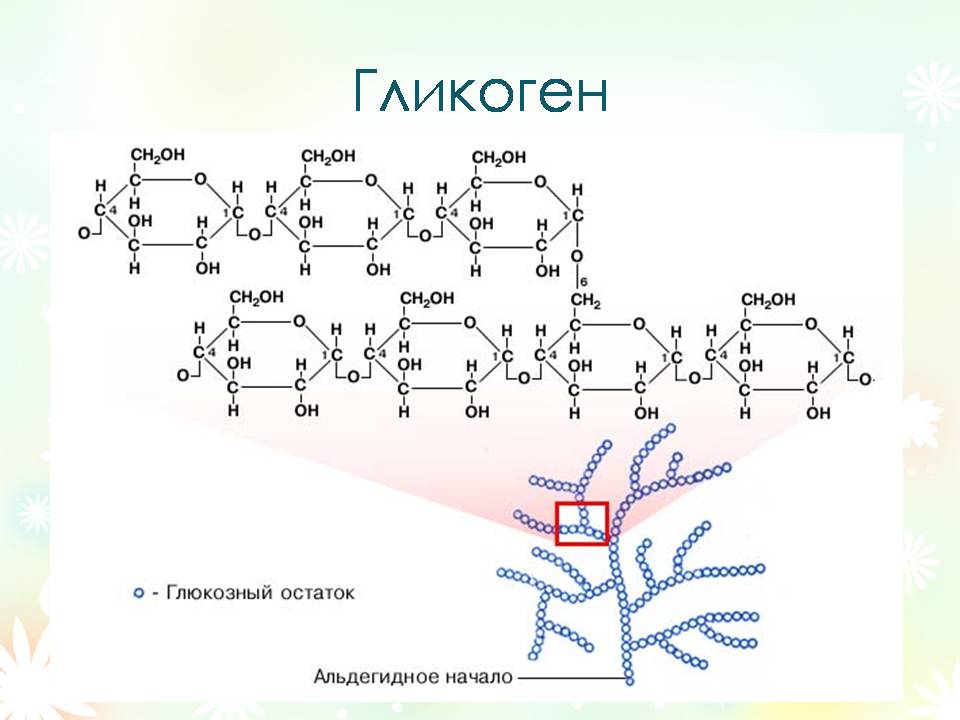
Гликоген - главный резервный полисахарид высших животных и человека, содержится в виде гранул в цитоплазме клеток практически во всех органах и тканях, но наибольшее его количество накапливается в мышцах и печени. Иногда его называется неточным термином «животный крахмал». Гликоген образует энергетический резерв, который восполняет недостаток глюкозы. Общая масса гликогена в печени взрослых может достигать 100—120 граммов. В мышцах гликоген расщепляется на глюкозу для локального потребления и накапливается меньших концентрациях. Общий запас в мышцах может превышать запас, накопленный в печени.
Целлюлоза (клетчатка) (С6Н10О5)п
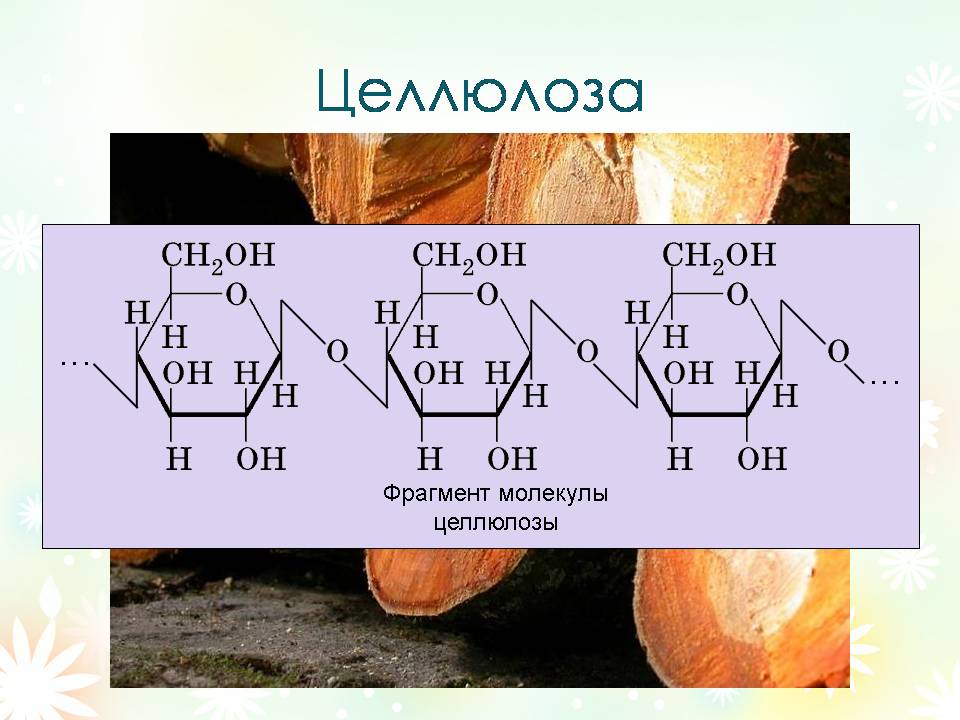
Целлюлоза - полисахарид растительного мира. Целлюлоза выполняет роль опорного материала растений. в составе древесины её доля от 50 до 70 %, а хлопок представляет собой практически стопроцентную целлюлозу
Хитин (С8Н13NО5)п (одежда)

Хитин - полисахарид грибов и беспозвоночных животных (членистоногих: насекомых и ракообразных). Хитин, подобно выполняет опорные и механические функции в организмах грибов и животных. Некоторые углеводы образуют комплексы с белками (гликопротеины) и липидами (гликолипиды)
Функции углеводов
В живых организмах углеводы выполняют следующие функции:
1. Энергетическая функция. Углеводы служат источником энергии: при полном расщеплении 1 грамма углеводов выделяются 17,6 кДж энергии
2. Структурная и опорная функции. Углеводы участвуют в построении различных опорных структур: целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов и обеспечивает жёсткость экзоскелета членистоногих.
3. Защитная роль у растений. У некоторых растений есть защитные смолы.
4. Пластическая функция. Углеводы входят в состав молекул ДНК и РНК.
5. Запасающая функция. Углеводы выступают в качестве запасных питательных веществ: гликоген у животных, крахмал — у растений.
Строение белков
Белки - полимеры, мономерами которых являются аминокислоты. В основном они состоят из углерода, водорода, кислорода и азота. Белки иначе называют протеинами. Содержание белков в разных клетках колеблется от 50 до 80 %. Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000.
Обычно в качестве мономеров белков называют 20 видов аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
Молекула белка может иметь 4 уровня и являются самыми важными компонентами клеток. структурной организации (первичная, вторичная, третичная и четвертичная структуры).
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют
Строение аминокислоты

Все аминокислоты содержат:
1. карбоксильную группу (–СООН),
2. аминогруппу (–NH2),
3. радикал или R-группу (остальная часть молекулы).
Строение радикала у разных видов аминокислот — различное. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная связь, которую и называют пептидной

Пространственная организация белковых молекул
Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Первичная структура белковой молекулы определяет свойства молекул белка. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в гемоглобине шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
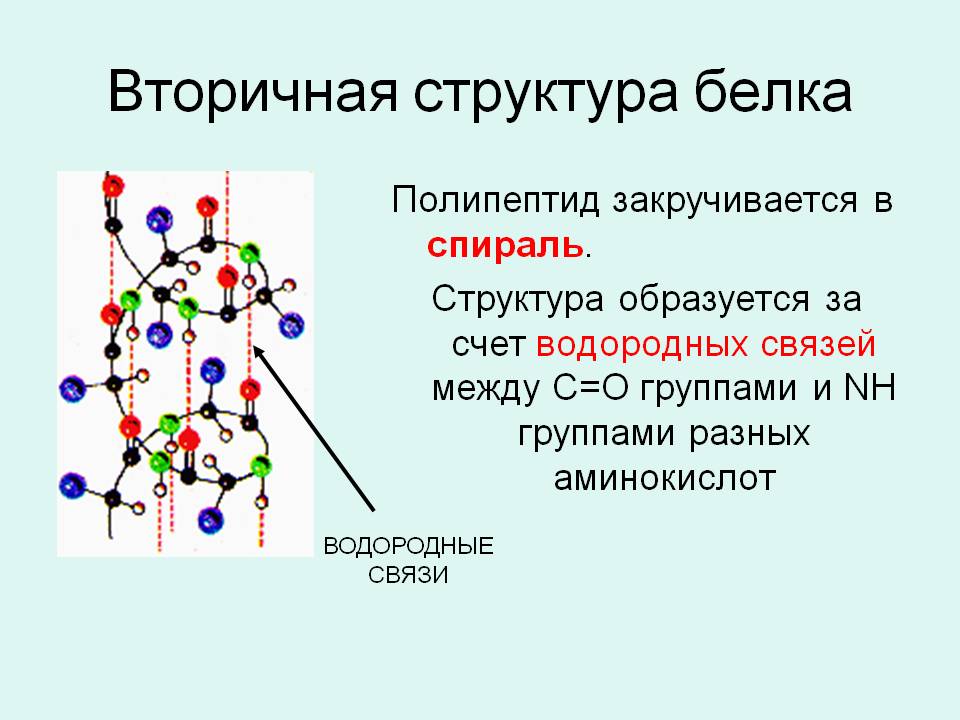
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль. Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
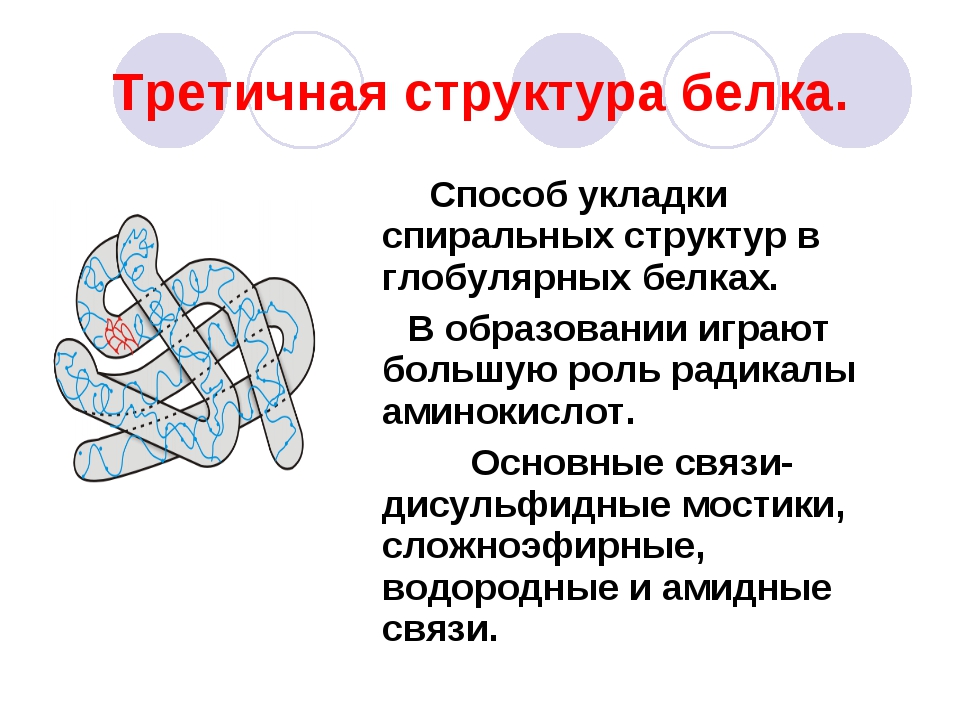
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. С каждой субъединицей связана молекула гема, содержащая железо. Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.

Свойства белков
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков:
1. Структурная (строительная). Белки участвуют в образовании клеточных и внеклеточных структур. Входит в состав клеточных мембран. Компонент перьев, волос, связок, стенок кровеносных сосудов.
2. Защитная. В ответ на проникновение в организм чужеродных белков или микроорганизмов образуются особые белки — антитела, способные связывать и обезвреживать их, интерферон усиленно синтезируется в организме при вирусной инфекции. Фибрин способствует остановке кровотечений.
3. Энергетическая. При распаде 1 г белка выделяется 17,6 кДж энергии. В качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.
4. Транспортная. Гемоглобин эритроцитов переносит питательные вещества и продукты обмена. В состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.
5. Регуляторная. Присуща белкам-гормонам. регуляторные белки определяют активность генов. Гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
6. Ферментативная. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках.
Липиды - неоднородная группа соединений, нерастворимых в воде и хорошо растворимых в органических растворителях (эфире, бензоле, ацетоне, хлороформе и др.). По химической природе липиды являются производными высших жирных кислот, спиртов или альдегидов.
Функции липидов в клетке:
1. являются структурными элементами клеточных мембран (фосфо-, гликолипиды, липопротеины, филлохиноны, стероиды);
2. при прорастании семян некоторых видов служат источником метаболической воды:
3. служат энергетическим материалом для организма (запасные вещества - жиры);
4. образуют водоотталкивающие (кутикула, восковой налет) и термоизоляционные покровы надземных органов растений; защищают от высыхания при недостатке влаги и вымывания веществ в период длительных дождей.
Нуклеиновые кислоты, строение и функции.
Нуклеиновые кислоты - это линейные неразветвленные гетерополимеры, мономерами которых являются нуклеотиды, каждый из которых состоит из азотистого основания, сахара-пентозы и остатка фосфорной кислоты. В состав нуклеиновых кислот входят пуриновые (аденин, гуанин – А, Г) и пиримидиновые (цитозин, урацил, тимин – Ц, Т, У) основания. При формировании двойной цепочки молекулы ДНК азотистые основания взаимодействуют друг с другом комплементарно - строго попарно за счет водородных связей ( А::Т(У), Г:::Ц).
Нуклеиновые кислоты обеспечивают:
1. хранение и воспроизведение генетического материала при делении клетки;
2. в интерфазе жизненного цикла клетки нуклеиновых кислот участвуют в реализации наследственной информации путем транскрипции и трансляции.
В клетках обнаруживается три основных типа РНК, выполняющих различные функции:
1. Информационная, или матричная РНК (иРНК, или мРНК). Служит для передачи генетической информации от ДНК на рибосомы при биосинтезе белка.
2. Рибосомальная РНК (рРНК). Входит в состав рибосом, определяет форму большой и малой рибосомных субъединиц, обеспечивает контакт рибосомы с другими типами РНК.
3. Транспортная РНК (тРНК). Транспортирует аминокислоты к соответствующему участку иРНК в рибосомах. Каждый тип тРНК транспортирует определенную аминокислоту.
Витамины (открыты русским ученым Н.И. Луниным в 1880 г.)
Витамины - группа низкомолекулярных биологически активных веществ, которые обеспечивают нормальное протекание биохимических и физиологических процессов путем участия в регуляции метаболизма. Витамины не синтезируются в организме человека и обязательно должны присутствовать в пище. Витамины делят на: 1) жирорастворимые: (А,D,Е, К, F), 2) растворимые в воде (В1...12, РР, Р, С, Н), 3) витаминоподобные соединения.
