Лекция по теме ФИЗИОЛОГИЯ ИММУННОЙ СИСТЕМЫ
План лекции:
1. Структура иммунной системы
2. Антигены
3. Активация лимфоцитов
4. Иммунный ответ гуморального типа
5. Антитела
6. Иммунный ответ клеточного типа
7. Факторы естественной резистентности
8. Регуляция иммунного ответа
1. СТРУКТУРА ИММУННОЙ СИСТЕМЫ
Организм животного устойчив ко всему для него генетически чужеродному. Такая устойчивость, или резистентность, организма к воздействию различных повреждающих факторов (как поступающих извне, так и к собственным измененным клеткам) обусловлена целым рядом защитных механизмов.
Прежде всего это механизм неспецифической защиты (естественная резистентность). Он представлен механическими барьерами кожи и слизистых оболочек, препятствующими проникновению микроорганизмов и другого чужеродного внутрь организма. Эти барьеры дополняются деятельностью мерцательного эпителия, свойствами слизи, лизоцима, лактоферина и интерферонов. В случае проникновения генетически чужеродного начала через кожу и слизистые оболочки в их удалении и удалении измененных клеток собственного организма участвуют комплемент, нейтрофилы, другие гранулоциты, макрофаги.
Помимо механизма неспецифической защиты в обеспечении устойчивости к инфекционным и другим чужеродным агентам участвуют механизмы специфической защиты — иммунная система, лимфоциты, антитела которые являются продуктом деятельности иммунной системы.
Иммунная система — это специальная система организма, обеспечивающая защиту его от всего генетически чужеродного, распознающая антигены, поступающие извне, и собственные измененные клетки. Она вместе с нервной и эндокринной системами обеспечивает поддержание постоянства иммунного статуса организма и его приспособление к изменяющимся условиям внешней и внутренней среды, контролируя качественное постоянство генетически обусловленного клеточного и гуморального состава организма.
Иммунная система обеспечивает:
1) защиту организма от внедрения чужеродных клеток и от возникших в организме модифицированных клеток (например, злокачественных);
2) уничтожение старых, дефектных и поврежденных собственных клеток, а также клеточных элементов, не соответствующих данной фазе развития организма;
3) нейтрализацию с последующим удалением всех генетически чужеродных для данного организма высокомолекулярных веществ биологического происхождения (белков, полисахаридов, липополисахаридов и др.);
4) продукцию разнообразных биологически активных веществ, обладающих широким спектром действия и поддерживающих сложную ответную реакцию всего организма на внедрение чужеродных клеток, вирусов, иммунное повреждение, а также воспаление, репарацию и регенерацию (цитокинов, ростовых факторов, медиаторов воспаления и пр.);
5) вовлечение для оптимизации реализуемых ею защитных реакций нервной и эндокринной систем.
Иммунная система представлена совокупностью органов, тканей и клеток, деятельность которых обеспечивает иммунитет, механизмы регуляции их деятельности.
Органы и ткани иммунной системы подразделяются на центральные и периферические.
I. Центральные органы иммунной системы. К центральным органам иммунной системы относятся красный костный мозг, тимус (вилочковая железа), фабрициева бурса (у птиц) и лимфатические узлы кишечника (у млекопитающих); в период внутриутробного (антенатального) развития — печень.
Все клетки иммунной системы происходят из гемопоэтических (кроветворных) стволовых клеток красного костного мозга и печени (у плодов), которые затем дифференцируются. Главными клетками иммунной системы являются лимфоциты. В центральных органах иммунной системы происходит созревание лимфоцитов.

Красный костный мозг. Здесь происходят размножение и одновременно раннее, антигеннозависимое, созревание и дифференцировка (приобретение характерных морфологических и функциональных свойств) лимфоцитов. Уменьшение количества стволовых клеток костного мозга и нарушение их дифференцировки приводят к иммунодефицитам.
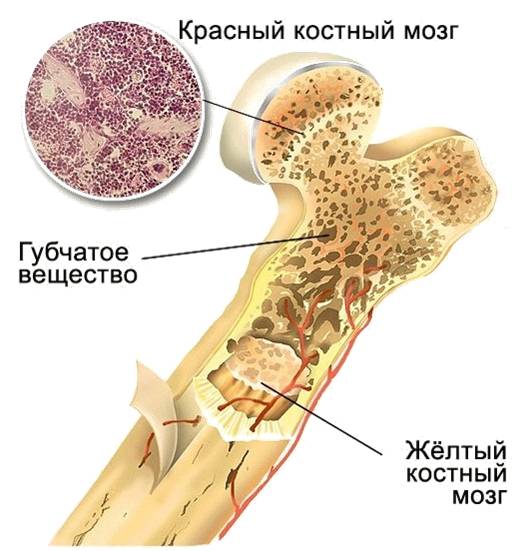
Тимус. В нем происходит дифференцировка клеток-предшественниц Т-лимфоцитов и превращение их в зрелые Т-лимфоциты. Часть созревающих Т-лимфоцитов направлены против собственных антигенов. Регулируют дифференцировку и функции Т-лимфоцитов вырабатываемые здесь же гормоны (например, тимозин).

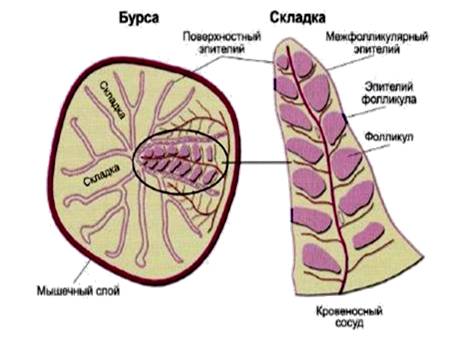
Фабрициева бурса (сумка) - дивертикул клоаки у птиц, где поселяются стволовые клетки. Здесь они созревают и дифференцируются в В-лимфоциты (называют бурсозависимыми). У млекопитающих созревание В-лимфоцитов осуществляется в лимфатических узлах кишечника.

В- и Т-лимфоциты от центральных органов переносятся кровью к периферическим органам иммунной системы. Т-лимфоциты в дальнейшем формируют клеточный иммунитет, а В-лимфоциты — гуморальный.
II. Периферические органы иммунной системы. В них поступают зрелые лимфоциты — это лимфоузлы, селезенка, лимфатические фолликулы по ходу пищеварительного тракта. Эти органы связаны между собой кровеносными и лимфатическими сосудами. Перемещаясь по этим сосудам, В- и Т- лимфоциты получают информацию об антигене, контактируя с ним, и передают ее во все органы иммунной системы, где они пролиферируют и дифференцируются, превращаясь в иммунокомпетентные клетки.
Лимфатические узлы - расположены по ходу лимфатических сосудов, задерживают антигены и предотвращают их распространение. В паренхиме лимфоузла различают корковое и мозговое вещество. Корковое вещество — В-зависимая зона (содержит лимфатические фолликулы, состоящие в основном из В-лимфоцитов); паракортикальная зона — Т-зависимая зона (Т-лимфоциты расположены преимущественно в паракортикальной зоне).

Селезенка - задерживает и уничтожает антигены, циркулирующие в крови. Лимфоидная ткань селезенки представлена островками белой пульпы, которые, подобно лимфоузлам, имеют фолликулярное строение и разделены на В- и Т-зависимые зоны.

Лимфатические фолликулы пищеварительного тракта - это миндалины, собственно лимфатические фолликулы и пейеровы бляшки. Лимфатические фолликулы также разделены на В- и Т-зависимые зоны. Большое количество лимфоцитов находится в собственной слизистой оболочке и среди клеток эпителия тонкого и толстого отделов кишечника.
Клетками иммунной системы являются лимфоциты (главные клетки иммунной системы) и фагоциты.
I. Лимфоциты. Это незернистые лейкоциты, развивающиеся из лимфоидных стволовых клеток. Они обладают уникальным свойством — способностью распознавать антиген. Лимфоциты подразделяют на В-, Т-лимфоциты и нулевые клетки. Т-лимфоциты составляют 70...80%, В-лимфоциты — 10...15% и оставшиеся лимфоциты, называемые нулевыми клетками, — около 10 % лимфоцитов крови.
Под световым микроскопом все лимфоциты выглядят одинаково. Их можно отличить друг от друга по антигенам клеточной поверхности, которые выявляются с помощью моноклональных антител, меченных флуоресцентными красителями, и функциям.
1. По антигенам клеточной поверхности:
· выявленные с помощью моноклональных антител антигены клеточной поверхности называют кластерами дифференцировки и обозначают буквами CD (кластер дифференцировки) и нумеруют: CD1 — Т-лимфоциты коркового вещества тимуса, CD2 – Т- и NK-лимфоциты, CD3 – Т-лимфоциты, CD4 — Т-лимфоциты, моноциты, CD5 — Т- и В-лимфоциты и т.д.
2. По функциям:
· В-лимфоциты способны вырабатывать антитела к разным антигенам и являются основными эффекторами гуморального иммунитета, т. е. ответственны за гуморальный иммунный ответ. От других клеток их отличает наличие иммуноглобулинов (в основном иммуноглобулины IgD и IgM) на клеточной мембране, которые служат специфическими рецепторами для антигенов;
· Т-лимфоциты участвуют в реакциях клеточного иммунитета: аллергических реакциях замедленного типа, реакции отторжения трансплантата и др., обеспечивают противоопухолевый иммунитет. Популяция Т-лимфоцитов включает две субпопуляции: лимфоциты CD4 — Т-хелперы и лимфоциты CD8 — цитотоксические Т-лимфоциты-киллеры и Т-супрессоры. Помимо этого существуют 2 типа Т-хелперов: Тh1 и Th2.
· Нулевые клетки (большие гранулярные лимфоциты) имеют ряд морфологических особенностей: они несколько крупнее В- и Т-лимфоцитов, имеют бобовидное ядро. По функциональным характеристикам нулевые клетки отличаются от В- и Т-лимфоцитов тем, что распознают антиген без ограничения по главному комплексу гистосовместимости (ГКГС) и не образуют клетки памяти. Одна из разновидностей нулевых клеток — NK-лимфоциты. На их поверхности есть рецепторы к Fc-фрагменту иммуноглобулинов, благодаря чему они могут присоединяться к покрытым антителами клеткам-мишеням и разрушать их. Это явление получило название антителозависимой клеточной цитотоксичности. NK-лимфоциты могут разрушать клетки-мишени, например опухолевые или инфицированные вирусами, и без участия антител.
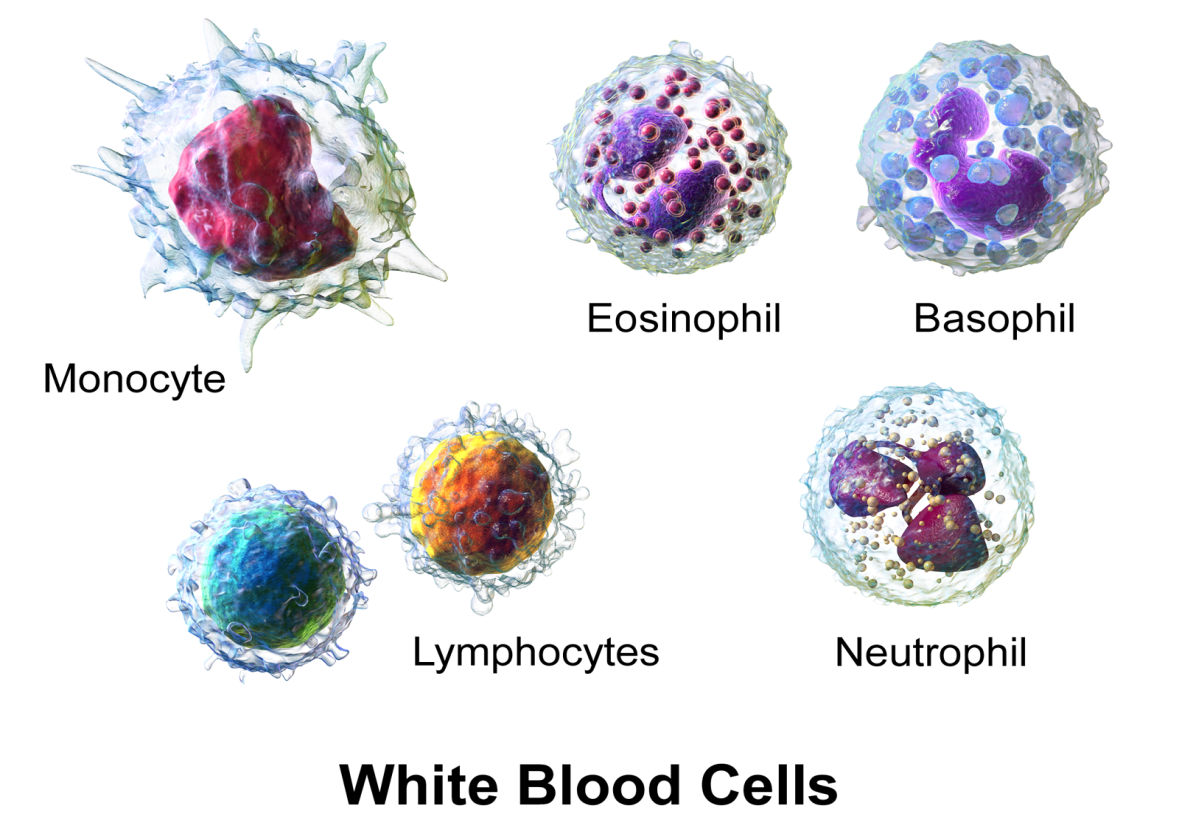
II. Фагоциты. К фагоцитам относят макрофаги, моноциты, гранулоциты (нейтрофилы, эозинофилы, базофилы). Они мигрируют в очаг воспаления, проникая в ткани сквозь стенки капилляров, поглощают и переваривают антиген.
1. Макрофаги и моноциты. Клетки — предшественницы макрофагов — моноциты, выйдя из костного мозга, в течение нескольких суток циркулируют в крови, а затем мигрируют в ткани. Роль макрофагов в иммунитете исключительно важна — они обеспечивают фагоцитоз, переработку и представление антигена Т-лимфоцитам. Макрофаги вырабатывают ферменты, некоторые белки, кислородные радикалы, простагландины и лейкотриены, цитокины (интерлейкины-1, -6; фактор некроза опухолей и др.). Моноциты являются также предшественниками клеток Лангерганса, клеток микроглии и других, способных к переработке и представлению антигена. В отличие от В- и Т-лимфоцитов макрофаги и моноциты не способны к специфическому распознаванию антигена.
2. Нейтрофилы. Основная функция — фагоцитоз. Действие нейтрофилов, как и макрофагов, неспецифично.
3. Эозинофилы. Играют важную роль в защите от гельминтов и простейших. Они обезвреживают и разрушают токсины белкового происхождения, чужеродные белки. По свойствам сходны с нейтрофилами, но обладают меньшей фагоцитарной активностью. В норме эозинофилы угнетают воспаление, так как вырабатывают фермент гистаминазу.
4. Базофилы и тучные клетки. Синтезируют и выделяют медиаторы — гистамин, лейкотриены, простагландины, фактор активации тромбоцитов, которые повышают проницаемость сосудов и участвуют в воспалении. Базофилы циркулируют в крови, время их жизни составляет всего несколько суток. Тучные клетки, которых значительно больше, чем базофилов, находятся в тканях. Базофилы и тучные клетки несут на своей поверхности рецепторы иммуноглобулина IgEn играют важнейшую роль в аллергических реакциях немедленного типа.
Специфические и неспецифические защитные механизмы.
К специфическим механизмам защиты относят гуморальное и клеточное звенья иммунной системы. Специфичность механизма заключается в способности распознавать антиген и сохранять память о нем.
К неспецифическим механизмам защиты относят фагоцитоз и опосредованное комплементом разрушение клеток.
Функционально специфические и неспецифические механизмы тесно связаны. Развитие иммунного ответа невозможно без участия макрофагов, в то же время активность макрофагов регулируется лимфоцитами.
2. АНТИГЕНЫ
Антигены (греч. anti — против, genes — порождающий) — высокомолекулярные соединения, которые, специфически стимулируя иммунокомпетентные клетки, вызывают иммунную реакцию и взаимодействуют с продуктами этой реакции: антителами и активированными лимфоцитами.
Антигенными свойствами могут обладать чужеродные белки (сыворотки, экстракты тканей), другие высокомолекулярные и более простые соединения. Правда, низкомолекулярные вещества сами по себе вызывать образование антител не могут, но вступают в реакцию взаимодействия с иммуноглобулинами, которые вырабатывались под воздействием конъюгированных с ними высокомолекулярных соединений (белков). Высокомолекулярные соединения, индуцирующие антителообразование и взаимодействующие с иммуноглобулинами, называют иммуногенами, а низкомолекулярные, только реагирующие с антителами, — гаптенами (греч. hapto — схватываю).
В современной иммунологии антигенами называют иммуногены и гаптены, которые, активируя иммунокомпетентные клетки, вызывают образование иммуноглобулинов и развитие многих других иммунологических (защитных) процессов.
Классификация антигенов
1. По происхождению:
· естественные (белки, углеводы, нуклеиновые кислоты, бактериальные эндо- и экзотоксины, антигены клеток тканей и крови);
· искусственные (динитрофенилированные белки и углеводы);
· синтетические (синтезированные полиаминокислоты, полипептиды).
2. По химической природе:
· белки (гормоны, ферменты; сывороточные, яичные, молочные белки);
· углеводы (декстран, леван); нуклеиновые кислоты ДНК РНК);
· конъюгированные антигены (динитрофенилированные белки);
· полипептиды (полимеры альфа-аминокислот, кополимеры глутамина и аланина);
· липиды (холестерин, лецитин, которые могут выступать в роли гаптена, а соединившись с белками сыворотки крови, приобретают антигенные свойства). Сами по себе гаптены неиммуногенны, однако, будучи связанными с соответствующим носителем, способны вызывать реакции иммунного ответа.
3. По генетическому отношению донор — реципиент:
· аутоантигены (происходят из тканей собственного организма);
· изоантигены (происходят от генетически идентичного — сингенного донора);
· аллоантигены (происходят от неродственного донора того же вида);
· ксеноантигены (происходят от донора другого вида).
В тех случаях, когда антигены вызывают иммунный ответ, их называют иммуногенами. Антигены, приводящие к снижению реактивности организма к этому антигену (толерантности), называют толерогенами.
Иммуногенность антигена зависит от целого ряда факторов:
1. Молекулярной массы. Низкомолекулярные вещества (моносахариды, аминокислоты, липиды) не являются иммуногенами. Вещества с молекулярной массой 5...10 кД обладают слабовыраженными иммуногенными свойствами. Сильными иммуногенами являются вещества с молекулярной массой в несколько миллионов дальтон.
2. Химической неоднородности.
3. Генетической чужеродности. Иммуноген должен обладать генетически чужеродными свойствами по отношению к данному организму.
4. Дозы антигена. Низкие дозы вызывают выработку небольшого количества антител с высокой аффинностью. С увеличением дозы вводимого антигена выраженность иммунного ответа повышается. Однако следует учитывать, что большие дозы могут вызывать состояние иммунологической толерантности (специфической ареактивности).
5.Способа введения антигена. Предпочтительнее антиген вводить внутрикожно или подкожно.
6. Применения адъювантов — веществ, усиливающих иммуногенность антигена.
Сильными иммуногенами являются чужеродные протеины, гликопротеиды, липопротеиды и другие белки в комплексе с гаптенами, сложные полисахариды капсул пневмококка, липополисахариды энтеробактерий, нуклеиновые кислоты соматических клеток, многие искусственные высокополимерные соединения.
Формирование иммунного ответа зависит и от генетически обусловленной способности организма реагировать на чужеродные вещества. Иммунный ответ к определённому антигену контролируется Ir-генами (Immune respons), расположенными в D/DR области главного комплекса гистосовместимости (МНС). У человека она обозначается HLA (human leukocyte antigens), у мышей – Н-2, у собак – DLA, у свиней - SLA. В антигеном распознавании участвуют антигены МНС классов I и II.
3. АКТИВАЦИЯ ЛИМФОЦИТОВ
Согласно клонально-селекционной теории иммунитета существует столько субпопуляций лимфоцитов, сколько существует антигенов. Иммунный ответ является специфическим, так как проникший в организм антиген избирательно связывается только с теми клетками, на поверхности которых имеются соответствующие рецепторы. С остальными клетками данный антиген не взаимодействует. Связывание антигена способствует активации лимфоцита, т.е. к его делению и дифференцировке. В результате происходит антителообразование у В-клеток и появление цитотоксической активности у части Т- лимфоцитов. До контакта с антигеном лимфоциты находятся в состоянии покоя. После контакта с антигеном происходит пролиферация (размножение) лимфоцитов и процессы созревания, различные в разных субпопуляциях. В итоге каждая субпопуляция лимфоцитов приобретает набор присущих только ей поверхностных антигенов и специфических функций.
Факторы, влияющие на активацию лимфоцитов:
· антигены, к которым имеются специфические рецепторы на лимфоцитах - это антигенсвязывающие клетки;
· антитела к иммуноглобулинам;
· интерлейкины IL-1, IL-2;
· инсулин – он активирует лимфоциты.
Угнетают активацию лимфоцитов следующие факторы:
· липиды очень низкой плотности (ЛОНП);
· фрагменты компонентов системы комплемента С3е, С3с и С3d, ингибирующие пролиферацию Т-клеток и синтез антител ответ на антигенную стимуляцию.
Активация В-лимфоцитов
Они реагируютна три различных типа антигенов:
1) тимуснезависимый антиген типа 1 (бактериальный липополисахарид).
2) тимуснезависимый антиген типа 2- полимеры D- аминокислот, поливонил-пирролидон, полисахарид пневмококков.
3) тимусзависимый антигены, которые не способны активировать В-клетку.
При связывании поверхностных рецепторов (Ig М) В-клеток с антигеном или антителами сначала усиливается поступление в В-лимфоцит ионов Са 2+ и активация протеинкиназ. Затем на поверхности лимфоцита увеличивается количество молекул МНС класса II и Т-хелперов, в результате чего В-лимфоциты приобретают специфические рецепторы и приступают к пролиферации.
Активация Т-лимфоцитов:
Для активации Т-лимфоцитов необходимо наличие антигена на поверхности антигенпрезентирующей клетки. Активированные Т-клетки синтезируют:
· IL-2, стимулирующий деление клеток, имеющих рецептор к IL-2;
· лимфокин BSF-1, активирующий В-клетки;
· лимфокин BSF-2, стимулирующий клональную экспансию активированных В-лимфоцитов;
· лимфокин BСDF-1, фактор дифференцировки В-клеток, способствующий созреваению клеток с высокой скоростью секреции IgМ;
· лимфокин BСDF- фактор, вызывающий переключение с синтеза IgМ на Ig G и его высокую скорость секреции.
4. ИММУННЫЙ ОТВЕТ ГУМОРАЛЬНОГО ТИПА
Гуморальный иммунитет связан с образованием антител. Различают два типа иммунного ответа гуморального типа: Т- зависимый и Т-независимый.
Формирование иммунного ответа происходит в несколько этапов:
1. Первый этап – распознание антигена лимфоцитами, при этом образуется комплекс антиген-антитело. В результате происходит перегруппировка рецепторов на поверхности клетки и образование шапочек на одном из полюсов клетки.
2. На втором этапе происходит межклеточная кооперация: к формированию иммунного ответа подключаются антигенпрезентирующие клетки: макрофаги, моноциты, дендроциты, интерстициальные клетки, клетки Лангерганса, эпидермис, эндотелий и Т-лимфоциты. В кооперации антигенпрезентирующих клеток участвуют медиаторы IL- 1 и интерферон. IL- 1 активирует Т-индукторы и Т-хелперы, а интерферон – макрофаги.
3. На третьем этапе благодаря клеточной кооперации начинается синтез антител и формируется иммунный ответ.
Выделяют 3 стадии первичного иммунного ответа. В латентную стадию, которая занимает одну неделю, антитела к соответствующему антигену в сыворотке отсутствуют. На второй стадии – log-фаза - спустя 10... 14 суток после контакта с антигеном появляются — IgG. На третьей стадии (пик-фаза) уровень антител вначале остается постоянным, затем наблюдается постепенное снижение уровня антител вследствие прекращения их синтеза.
Вторичный иммунный ответ развивается при повторном контакте с антигеном. Антитела, главном образом иммуноглобулины IgG, появляются быстрее и в более высоком титре, чем при первичном иммунном ответе.
5. АНТИТЕЛА
Антителам присущи следующие основные биологические свойства.
1. Специфичность — способность Ig реагировать только с определенным антигеном, что обусловлено наличием у них антидетерминант, контактирующих с соответствующими детерминантами.
2. Валентность — количество антидетерминант в молекуле антитела. Чаще всего антитела бивалентны, но существуют 5- и даже 10-валентные.
3. Аффинность, аффинитет — прочность соединения между детерминантами (эпитопом) антигена и антидетерминантами (паратопом) антигена.
4. Авидность — прочность связи антигена с антителом. Благодаря поливалентности антигена связь между двумя антигенами осуществляется при помощи нескольких антител.
5. Гетерогенность — неоднородность, обусловленная наличием трех видов антигенных детерминант:
A. Изотипические, характеризующих принадлежность Ig к определенному классу;
Б. Аллотипические, соответствующие аллельным вариантам иммуноглобулина;
B. Идиотипические, отражающие индивидуальные особенности иммуноглобулина.
Организм способен реагировать на поступление чужеродных антигенов синтезом белков, обладающих специфическим сродством с антигеном, вызвавшим этот синтез. Эти белки получили название антител. Хотя антитела отличаются друг от друга не только по способности связывать разные антигены, но и по своим физико-химическим свойствам, структурно все они сходны. Эта высокоспециализированная группа белков, построенных из полипептидных цепей двух основных типов (легких и тяжелых), получила название иммуноглобулинов.
Иммуноглобулины синтезируются в пузырьках пластинчатого аппарата (Гольджи) В-лимфоцитов. По мере созревания пузырек подходит к поверхности клетки, при контакте с ней происходит разрыв наружной мембраны клетки и мембраны пузырька. Свободные иммуноглобулины поступают в плазму, а связанные с мембраной остаются на поверхности клетки. Таким образом, итоговой фазой В-клеточного иммунитета является продукция Ig-антител, которая происходит постоянно. Одновременно в организме синтезируются до 105...107 антител различной специфичности. Интактный В-лимфоцит синтезирует в один час примерно 250...500 молекул IgМ и большую часть их отдает в экстрацеллюлярную жидкость. После специфической антигенной стимуляции и трансформации лимфоцитов в плазматические клетки этот синтез возрастает в тысячи раз.
В настоящее время известно пять классов иммуноглобулинов: IgА, IgМ, IgG, IgD, IgЕ.

Защитное действие иммуноглобулинов заключается в прямом повреждении микроорганизмов или в нейтрализации выделяемого ими токсина.
· IgG — основные иммуноглобулины плазмы крови. Обладают максимальной способностью проникать в ткани. Поэтому наиболее эффективно связывают и удаляют антигены (нейтрализация, опсонизация, агглютинизация антигенов, разрушение бактерий, гемолиз). Вырабатываются как при первичном, так и при вторичном иммунном ответе. Основной класс иммуноглобулинов, вырабатываемых при вторичном иммунном ответе; Ig G оказывают сильное нейтрализирующее действие на токсины и вирусы, способны к преципитации, обладают опсонирующим действием, т.е. в присутствии комплемента стимулируют поглощение чужеродных частиц, бактерий, вирусов и их разрушение лейкоцитами, усиливают фагоцитоз.
· IgM— иммуноглобулины, проникающие в ткани (исключение — не проходят через плаценту). Ig М – самые первые антитела у новорождённых, не способные в полной мере к нейтрализации токсинов. Осуществляют нейтрализацию, опсонизацию и агглютинизацию антигенов, вызывают разрушение микроорганизмов бактерий, гемолиз (обеспечивают первую линию защиты организма). Являются естественными антителами к эритроцитарным антигенам А, В и др. Они — антигенраспознающий рецептор В-лимфоцитов и составляют основную долю иммуноглобулинов, вырабатываемых при первичном иммунном ответе;
· IgA — иммуноглобулины, находящиеся в секрете слизистых оболочек, в слюне, слезах, пищеварительных соках, секретах слизистой носа, молозиве (основной иммуноглобулин) и крови. Они осуществляют нейтрализацию антигена на уровне слизистых оболочек, т. е. обеспечивают местную защитную реакцию; Ig А не способны к связыванию комплемента, не могут вызывать ни иммуноприлипания, ни цитолиза или конглютинации. Они защищают организм от проникновения возбудителя и развития инфекции. Они удаляют пищевые и другие чужеродные антигены, проникающие в организм через слизистые оболочки, а также регулируют иммунный ответ на эти антигены.
· Ig D—иммуноглобулины, находящиеся на мембранах В-лимфоцитов. Выполняют роль рецепторов, обеспечивающих распознавание антигенов; в плазме их мало. Участвуют в развитии местного иммунитета, обладают антивирусной активностью, в редких случаях могут активировать комплемент.
· Ig E—иммуноглобулины, фиксированные на мембранах тучных клеток и базофилах. Связываются с антигеном с высвобождением медиаторов воспаления. Повышают проницаемость сосудов при контакте с антигеном, участвуют в аллергических реакциях немедленного типа. Уровень Ig Е существенно повышается у организмов, страдающих аллергией и зараженных гельминтами.
6. ИММУННЫЙ ОТВЕТ КЛЕТОЧНОГО ТИПА
Клеточный иммунитет связан с образованием специализированных клеток, реагирующих с антигеном посредством его связывания и последующего разрушения. Иммунная реакция опосредована клетками — цитотоксическими Т-лимфоцитами и Т-хелперами. Цитотоксические Т-лимфоциты непосредственно контактируют с чужеродными клетками и разрушают их, а Т-хелперы вырабатывают биологически активные вещества — цитокины, активирующие макрофаги. Иммунизация, вызванная контактом с антигеном и связанная с развитием иммунного ответа клеточного типа называется сенсибилизацией. По способности вырабатывать разные цитокины и участвовать в регуляции клеточного и гуморального иммунитета Т-хелперы подразделяют на Th 1 и Th 2. Первые вырабатывают интерферон-γ и интерлейкин-2, стимулируют пролиферацию цитотоксических Т-лимфоцитов и активируют макрофаги, вторые — интерлейкины-4, -5, -6, стимулируют пролиферацию и дифференцировку В-лимфоцитов, а также синтез антител разных классов.
Т-клетки связывают антигены, если они ассоциированы с расположенными на поверхности животных клеток определенными антигенными структурами, которые называются главным комплексом гистосовместимости.
Главный комплекс гистосовместимости (ГКГС) — это группа генов и кодируемых ими антигенов клеточной поверхности, которые играют важнейшую роль в распознавании чужеродного и развитии иммунного ответа. Антигены ГКГС подразделяют на антигены классов I и П. Антигены ГКГС класса I участвуют в распознавании трансформированных клеток ци-тотоксическими Т-лимфоцитами. Антигены ГКГС класса II обеспечивают взаимодействие между Т-лимфоцитами и макрофагами в процессе иммунного ответа. Т-хелперы распознают чужеродный антиген лишь после его переработки макрофагами, соединения с антигенами ГКГС класса II и появления этого комплекса на поверхности макрофага. Способность Т-лимфоцитов распознавать чужеродные антигены только в комплексе с антигенами ГКГС называют ограничением по ГКГС.
Клеточный иммунитет проявляется в виде:
1)аллергических реакций замедленного типа (например, туберкулиновые пробы, аллергический контактный дерматит);
2)защиты против внутриклеточных паразитов –грибов, вирусов и бактерий;
3)противовирусного и противомикозного иммунитета;
4)отторжения трансплантата;
5)реакций клеточного типа при аутоиммунных расстройствах;
6)противоопухолевого иммунитета.
Вещества, активирующие и координирующие взаимодействие Т-клеток, называются интерлейкинами (лимфокинами), стимулирующие В-клетки или макрофаги – факторами, индуцирующие образование и дифференциации, других кроветворных клеток – гемопоэтинами. Сейчас их всех называют цитокинами. Различают цитокины приобретенного и естественного иммунитета.
Цитокины приобретенного иммунитета обеспечивают:
· активацию, рост и дифференциацию лимфоцитов;
· активацию неспецифических клеток воспаления;
· стимулируют гемопоэз.
К первой группе относят интерлейкин-2, интерлейкин-4, трансформирующий рост-фактор β.
Ко второй группе относят γ – интерферон, лимфотоксин и интерлейкин-5.
К третьей группе относят два интерлейкина IL-3, IL-7 и три колониестимулирующих фактора.
Цитокины природного иммунитета – это интерферон I типа, фактор некроза опухолей, IL-1, IL-6 и IL-8.
7. ФАКТОРЫ ЕСТЕСТВЕННОЙ РЕЗИСТЕНТНОСТИ
К факторам естественной резистентности относят:
1) естественные барьеры — кожа, слизистые оболочки, первые вступают в контакт с возбудителем инфекций;
2) система фагоцитов, включающая нейтрофилы и макрофаги;
3) система комплемента (совокупность сывороточных белков), тесно взаимодействующих с фагоцитами;
4) интерфероны;
5) различные вещества, чаще всего белковой природы, участвующие в реакциях воспаления, фибринолиза и свертывания крови. Некоторые из них (лизоцим) обладают прямым бактерицидным действием;
6) систему естественных (нормальных) киллеров, не обладающих антигенной специфичностью (Т- и К-киллеры).
ЕСТЕСТВЕННЫЕ БАРЬЕРЫ
Главная роль в обеспечении барьерной функции отводится коже, которая, будучи неповрежденной, непроницаема для большинства инфекционных агентов. Способность кожи к десквамации клеток обеспечивает механическое удаление агента. Воздействие молочной кислоты и жирных кислот, содержащихся в поте и секретах сальных желез и обусловливающих низкое значение рН, оказывается губительным для большинства бактерий. Исключение составляет Staphylococcus aureus, часто инфицирующий волосяные фолликулы и железы.
Секрет, выделяемый мукоцеллюлярным аппаратом бронхов, желудка, кишечника и других внутренних органов, действует как защитный барьер: препятствует прикреплению бактерий к эпителиальным клеткам и механически удаляет их за счет движения ресничек эпителия (при кашле, чихании).
Вымывающее действие слез, слюны, мочи способствует защите эпителия от повреждений, вызванных в результате деятельности патогенных агентов. Во многих биологических жидкостях, секретируемых организмом, содержатся вещества, обладающие бактерицидными свойствами (например, соляная кислота в желудочном соке; спермин и цинк в сперме; лизоцим в слезах, носовых выделениях и слюне; лактопероксидаза в молоке).
Благодаря микробному антагонизму, связанному с присутствием нормальной бактериальной флоры, угнетается рост ряда потенциально патогенных бактерий и грибов вследствие конкуренции за необходимые питательные вещества или выработки некоторых веществ (кислоты). Например, патогенная флора влагалища угнетается молочной кислотой, которая вырабатывается одним из видов бактерий — комменсалов, метаболизирующих гликоген, секретируемый клетками эпителия влагалища. Защитной является и фильтрационная функция лимфатических узлов.
Если же микроорганизмы все же преодолевают эти естественные барьеры макроорганизма, то в действие вступают следующие два способа защиты: разрушение их ферментами либо «поедание» клетками — фагоцитоз.
СИСТЕМА ФАГОЦИТОВ
И. И. Мечников определил, что ее представляют два типа клеток: микрофаги (полиморфноядерные нейтрофилы) и макрофаги, трансформирующиеся из моноцитов, которые задерживаются в тканях. Они образуют систему мононуклеарных фагоцитов.
Всем фагоцитам присущи следующие функции: миграция и хемотаксис; адгезия и фагоцитоз; цитотоксичность; секреция гидролаз и других биологически активных веществ.
Защитную функцию клеток, способных поглощать и переваривать микробы, впервые показал И. И. Мечников и назвал это явление фагоцитозом.
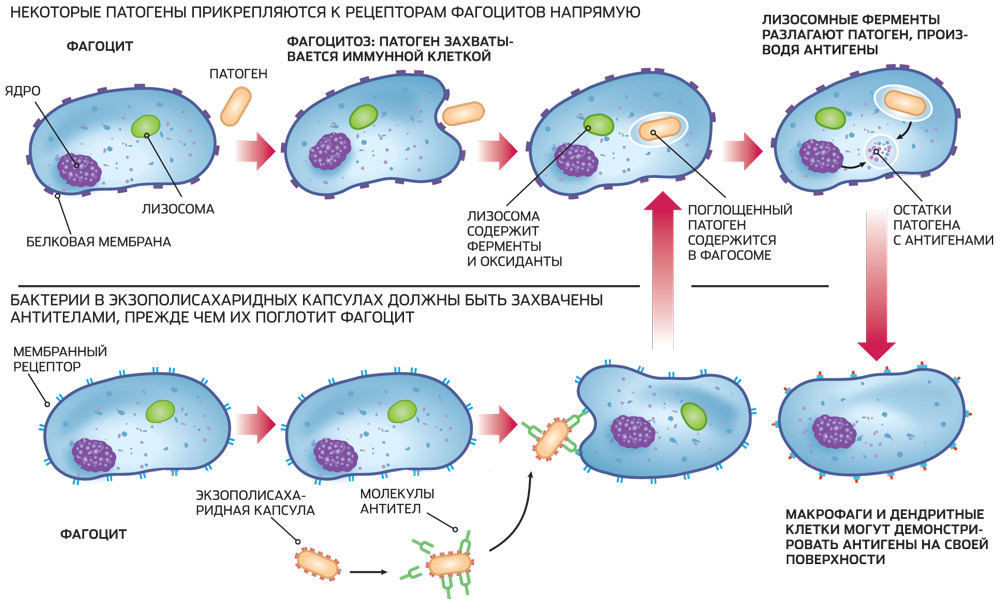
Различают фагоцитоз завершенный и незавершенный. Фагоцитарная реакция осуществляется поэтапно. Завершенный фагоцитоз, заканчивающийся полным разрушением микроорганизма, включает четыре стадии:
I. Положительный таксис, или приближение фагоцита к микробу;
II. Адгезия, или прилипание фагоцита к микробу;
III.Впячивание наружной
мембраны фагоцита с последующим
образованием фагосомы и ее слияние с лизосомой;
IV.Инактивация
и разрушение микробов в фаголизосоме,
проявляющиеся набуханием, фрагментацией и лизисом с пол
ной деградацией до аминокислот и низкомолекулярных соедине
ний. Если микробные антигены разрушаются частично, вслед за
фагоцитозом начинается антителообразование.
Некоторые виды микроорганизмов и особенно поглощенные вирусы проявляют большую устойчивость к лизосомальным антимикробным веществам или даже размножаются внутри фагоцита. Такой незавершенный вид фагоцитоза чаще наблюдается в нейтрофилах и заканчивается их гибелью или фагоцитированные микробы выталкиваются из них. Нередко гранулоциты с размножившимися в них бактериями становятся объектом фагоцитоза для макрофагов. Следует подчеркнуть, что в отличие от нейтрофилов, которые поглощают и переваривают в основном истинных бактерий, макрофаги фагоцитируют спирохеты, актиномицеты, грибы, простейшие, вирусы, атрофирующиеся, омертвевшие или злокачественные перерожденные клетки.
Нейтрофилы (полиморфноядерные лейкоциты) — короткоживущие клетки, способные к хемотаксису и фагоцитозу. В нейтрофилах различают три типа гранул:
· первичные, азурофильные, содержат набор разнообразных гидролаз —A,D,E катепсины, 5-нуклеотидазу, бета-галактозидазу, арил-сульфатазу, бета-глюкуронидазу, эластазу, коллагеназу, катионные белки, миелопероксидазу, лизоцим, кислые мукополисахариды;
· вторичные «специфические» гранулы содержат лактоферрин, лизоцим, щелочную фосфатазу, белок, связывающий витамин В12;
· третичные гранулы похожи на обычные лизосомы и содержат кислые гидролазы.
Таким образом, гранулы нейтрофилов содержат набор ферментов, достаточный для деградации всех или многих липидов, полисахаридов и белков чувствительных бактерий, что приводит к их значительному повреждению в считанные часы.
Моноциты и макрофаги отличаются высокой фагоцитарной активностью. Продукты этих клеток — монокины — действуют на многие клетки других типов. Моноциты могут участвовать как в воспалительных, так и противовоспалительных процессах: способствовать созреванию предшественников лейкоцитов, влиять на систему комплемента, свертывание крови, обмен кининов, служить основным источником метаболитов арахидоновой кислоты, а также оказывать токсическое действие на опухолевые клетки и микроорганизмы.
Макрофаги играют важную роль в формировании устойчивости организма к инфекции. Они обладают фагоцитарной активностью, значительной подвижностью и способностью образовывать токсические метаболиты кислорода, а также набором мощных гидролитических ферментов. В отличие от нейтрофилов у макрофагов замедленная, но более продолжительная реакция на внешние стимулы. Они способны использовать фаголизосомы повторно, секретировать нелизосомальные белки. У них выше способность к пиноцитозу. Макрофаги быстрее реконструируют плазматическую мембрану, но характер их бактерицидного действия во многом сходен с таковым у нейтрофилов: включает интернализацию микроорганизмов, слияние фагосом с лизосомами и активацию метаболитов кислорода при уничтожении микроорганизмов.
Между моноцитами и макрофагами обнаружено много различий: прежде всего эти клетки отличаются по ферментативной активности и способности к фагоцитозу. При дифференцировке моноцитов в макрофаги у них исчезают азурофильные гранулы, в результате более заметными становятся лизосомы, содержащие гидролитические ферменты. Поверхность макрофагов более складчатая и на ней больше рецепторов для Ig и комплемента.
Макрофаги (и, в меньшей степени, неактивированные моноциты) продуцируют разнообразные соединения: компоненты комплемента, пропердин, факторы В и D. Гепатоциты производят многие из этих белков в значительно больших количествах, однако макрофаги обеспечивают локальный синтез белков комплемента в экссудатах.
Макрофаги продуцируют растворимые белки — монокины. К ним относятся: интерлейкин-1 (IL-1), лейкоцитарный пироген; фактор, активирующий фибробласты и пролиферацию гладкомышечных клеток, интерферон; факторы, стимулирующие пролиферация клеток капилляров; факторы, влияющие на образование колоний гранулоцитов, эритроцитов, макрофагов, мегакариоцитов; фактор роста Т-клеток; фактор дифференцировки В-клеток; белки, убивающие опухолевые клетки; белок, супрессирующий Т- и В-клетки.
Макрофаги продуцируют большое количество биологически активных веществ (БАВ): простагландины (PGE2), тромбоксан 2, лейкотриены В и С, причем в значительно больших количествах, чем нейтрофилы. Миелопероксидаза нейтрофилов и макрофагов эффективно уничтожает микроорганизмы, может играть существенную роль в уничтожении агентов, вызывающих хронические гранулематозные инфекции.
Пероксидаза в нейтрофильных лейкоцитах была впервые обнаружена в 1941 г. К. Агнером. Поскольку по своим свойствам эта пероксидаза несколько отличалась от остальных животных пероксидаз и найдена пока только в нейтрофилах, моноцитах и макрофагах, она впоследствии получила название «миелопероксидаза» (МПО). Методом гельфильтрации определена молекулярная масса миелопероксидазы: у собаки — 149000 (К. Агнер, 1958). МПО — это важный компонент внутрилейкоцитарной микробоцидной системы нейтрофильных гранулоцитов. Это железосодержащий белок, изоэлектрическая точка которого находится в области рН 10,0. Способность МПО окислять пероксидом водорода субстраты различной химической природы и продуцировать альдегиды, хлорамины, синглетный кислород, свободные радикалы и другие высокоактивные антимикробные агенты является биохимической основой иммунитета, главная роль в котором принадлежит нейтрофильным лейкоцитам.
Пероксидаза и пероксид водорода значительно усиливают антимикробную активность ряда фенолов посредством перевода их в соответствующие хиноны. В дальнейшем выяснили, что миелопероксидаза в присутствии пероксида водорода и окисляемого кофактора действует против различных микроорганизмов и их токсинов. Миелопероксидаза, пероксид водорода и окисляемый кофактор составляют антимикробную систему в лейкоцитах. В системе миелопероксидаза — пероксид водорода — галоген (кроме фтора) ионы галогенов взаимозаменяемы.
Система МПО — Н2О2 — йодид. Из всех галогенов йод считается наиболее эффективным кофактором при осуществлении миелопероксидазной системной антимикробной функции. Для эквивалентного антибактериального эффекта требуется или одна часть йодида, или 15 частей бромида, или 200 частей хлорида. Антимикробным действием обладает не только вся система МПО - Н2О2 — галоген в целом, но и некоторые ее компоненты. Агнер (1947) первым установил, что эта система йодинирует молекулы бактериальных ядов при их обеззараживании. Клебанов (1967) доказал, что антимикробная система МПО — Н2О2 — йодид обусловлена йодинацией микроорганизмов. Была доказана зависимость фиксации йодида фагоцитами, поглощающими бактерии, от содержания в них миелопероксидазы. Моноциты способны фиксировать йодид, но нейтрофилы, где содержится наибольшее количество миелопероксидазы, наиболее эффективно фиксируют йодид. При высоких бактериальных нагрузках активность нейтрофилов выше, чем у моноцитов. Полная антибактериальная функция системы МПО — Н2О2 — йодид соответствует антивирусной и антигрибной.
Система МПО — Н2О2 — хлорид. О переокислительном окислении хлорида впервые сообщил Агнер (1941). В настоящее время доказана активность системы МПО — Н2О2 — хлорид против бактерий, микоплаз и вирусов. Антимикробная актицность этой системы осуществляется за счет переокислительного дезаминирования и декарбоксилирования микроорганизмов. МПО катализирует образование НОС1 из С1 и Н2О2. НОС1 реагирует с аминокислотами с образованием хлораминов. Хлорамины нестабильны и распадаются на NH3, CO2, C1 и соответствующие альдегиды.
Существует определенная взаимосвязь и взаимодействие всех систем, выполняющих функции борьбы с чужеродными агентами. Так, продукты деградации IgG стимулируют увеличение уровня активности МПО. Агрегаты иммуноглобулинов, образующиеся при их окислительной деструкции, стимулируют дыхательный взрыв и секреторную дегрануляцию нейтрофилов с выделением МПО. Агрегаты оказывают и прямое воздействие на нейтрофилы, а также активируют систему комплемента. Последнее определяет образование стимуляторов дегрануляции этих клеток.
На основании данных о способности МПО вызывать секрецию cодержимого тромбоцитов высказывается предположение об участии МПО в процессах межклеточной коммуникации. Следует отметить, что пероксидаза слюны обладает способностью стимулировать митогенную активность лимфоцитов.
МПО играет роль в регуляции дыхательного взрыва. Один из продуктов миелопероксидазной реакции тормозит НАД-Н-оксидазу, ответственную за образование супероксидного радикала. Такой вывод сделан на основании сопоставления скорости генерации О2 и О2 на препаратах нейтрофилов человека, инкубируемых в присутствии и в отсутствие антимиелопероксидазных антител.
МПО нейтрофилов может служить фактором усиления антимикробного потенциала мононуклеарных фагоцитов клетки второй очереди при воспалительном процессе, а также и фактором потенцирования протеолиза деструктивных процессов в тканях. Так, она инактивирует ингибитор сериновых протеиназ — α-1-антитрипсин и SH-протеиназ путем тиолдисульфидного обмена и в то же время обладает способностью активизировать латентные формы металлопротеиназ нейтрофилов — коллагеназы и желатиназы.
Набор протеолитических ферментов макрофагов похож на соответствующий набор нейтрофилов, но активность протеаз в них существенно выше. Одним из ферментов, характерных для макрофагов, является ангиотензинконвертаза, катализирующая превращение ангиотензина-I в ангиотензин-II, реакцию инактивации брадикинина.
На макрофагах имеются рецепторы фибрина и продуктов деградации фибрина, способствующие более тесному взаимодействию клеток с продуктами свертывания. Макрофаги продуцируют заметное количество фибронектина, участвующего в клеточной адгезии, распластывании и движении клеток, а также содержат центры связывания коллагена и клеток, обладающих значительной хемотаксической активностью для фибробластов, что играет важную роль при восстановлении поврежденных тканей.
КОМПЛЕМЕНТ
Комплемент — это группа белков крови, состоящая из протеаз и их активаторов. Он содержит более чем 25 белков — компонентов комплемента, выявляемых в крови (9 белков плазмы: С1...С9) и на поверхности некоторых клеток. Комплемент играет важную роль в защите от чужеродного (микроорганизмов), являясь неспецифическим гуморальным защитным механизмом: он разрушает бактериальные и инфицированные вирусами собственные клетки, участвует в регуляции воспалительных и иммунных реакций. Некоторые фрагменты компонентов комплемента являются опсонинами. Опсонизированные клетки быстрее фагоцитируют, поскольку фагоциты активно связываются с этими клетками через соответствующие рецепторы.
Существует два механизма активации комплемента — классический и альтернативный.
Компоненты комплемента можно условно разделить на три группы: запускающие классический путь активации комплемента; запускающие альтернативный путь активации комплемента; эффекторные компоненты.
1.Классический путь активации комплемента. Начинается с присоединения белка плазмы — компонента С1 (состоит из трех белков-фрагментов компонента — Clq, Clr и СIs, образующих комплекс в присутствии ионов кальция) к иммунным комплексам, в состав которых входят IgG1, IgG2, IgG3 или IgM. После связывания фрагмента компонента комплемента (Clq) с иммунным комплексом происходит активация Clr и СIs, которые расщепляют белки плазмы — компоненты С4 и С2 с образованием комплекса С4Ь2а, который является C3-конвертазой классического пути. Этот фермент расщепляет белок плазмы — компонент СЗ с образованием фрагмента компонента СЗЬ, который, в свою очередь, активирует остальные компоненты комплемента.
2.Альтернативный путь активации комплемента. Начинается с расщепления белка плазмы — компонента СЗ. Биологический смысл такой активации комплемента заключается в том, что защита от чужеродного начинается до появления антител. Активацию комплемента по альтернативному пути вызывают инулин, зимозан, бактериальные полисахариды и агрегаты IgG4, I&A или IgE.
3. Образование мембраноатакующего комплекса. При активации комплемента как по классическому, так и по альтернативному пути белок плазмы — компонент СЗ расщепляется с образованием фрагмента компонента СЗЬ. Компонент СЗЬ выполняет множество функций.
На следующих этапах активации комплемента по классическому и альтернативному пути формируется комплекс С5Ь67, фиксированный на мембране чужеродной клетки. Присоединение к нему белка плазмы — компонента С8 вызывает частичное повреждение мембраны и медленное разрушение клетки. Когда к этому комплексу присоединяется компонент СР, образуется мембрано-атакующий комплекс — структура, которая встраивается в клеточную мембрану и нарушает ее целостность. Через образовавшийся канал в клетку устремляются вода и электролиты, что приводит к ее гибели.
ИНТЕРФЕРОНЫ
Интерфероны — антивирусные агенты. Существует по крайней мере 14 альфа-интерферонов, которые продуцируются лимфоцитами, а бета-интерферон—фибробластами.
При вирусной инфекции клетки синтезируют интерферон и секретируют его в межклеточное пространство, где он связывается с рецепторами соседних незараженных клеток. Связанный с клеткой интерферон дерепрессирует по меньшей мере два гена. Начинается синтез двух ферментов:
первый — протеинкиназа значительно снижает в конечном итоге трансляцию мРНК;
второй — катализирует образование короткого полимера аде-ниловой кислоты, активирующего латентную эндонуклеазу, что приводит к деградации мРНК как вируса, так и хозяина.
В целом конечный результат действия интерферона заключается в образовании барьера из неинфицированных клеток вокруг очага вирусной инфекции, чтобы ограничить ее распространение. Интерфероны играют большую роль в борьбе с вирусами, но не в предотвращении вирусных инфекций.
РАЗЛИЧНЫЕ ВЕЩЕСТВА БЕЛКОВОЙ ПРИРОДЫ
Пропердин (лат. perdere — разрушать) — белок, с помощью которого обнаружен альтернативный механизм активации комплемента. Он представляет собой гамма-глобулин с молекулярной массой 220000 и состоит из четырех практически идентичных субъединиц, соединенных друг с другом нековалентными связями. Его концентрация в сыворотке составляет около 25 мкг/мл. Пропердин существует в двух формах: нативной и активированной, различающихся между собой, по всей видимости, небольшими конформационными изменениями. Нативный пропердин может связываться с образовавшей комплекс СЗ/С5-конвертазой альтернативного механизма (СЗвВв), но не с одиночными молекулами СЗв. Его роль заключается в уменьшении скорости распада конвертазы и тем самым усилении активации по альтернативному механизму.
Пропердин действует, таким образом, не сам по себе, а совместно с другими факторами, содержащимися в крови животных, в том числе и с комплементом. Сама же система комплемента состоит из трех основных частей: пропердина, ионов Mg+2, комплемента. Активация пропердина осуществляется СЗ-компонентом комплемента. Пропердиновая система обладает антибактериальным действием в отношении многих патогенных и условно патогенных микроорганизмов. Под действием пропердина инактивируются вирусы герпеса и гриппа. Показатель уровня пропердина в крови в определенной мере отражает чувствительность животных к инфекции. Установлено, что происходит снижение содержания пропердина при туберкулезе, стрептококковой инфекции, ионизирующем облучении. Изъятие из сыворотки крови пропердина резко снижает ее нейтрализующую активность. Полная инактивация пропердина происходит при нагревании до 60 °С в течение 30 мин.
Лизоцим — фермент, относящийся к классу гидролаз, избирательно гидролизующий гликозидные связи в муреине — сложном биополимере, из которого построены стенки бактерий. Молекулярная масса лизоцима 14 000... 15 000. Это стойкий белок, не теряющий литической способности при нагревании до 100° С. Способность лизоцима лизировать микроорганизмы столь высока, что это свойство сохраняется в разведении 1:1 000 000. Главная роль в образовании активного центра принадлежит, по-видимому, триптофану.
Ферментативная активность лизоцима проявляется в гидролизе 1,4-гликозидной связи полиаминосахаров клеточной стенки преимущественно грамположительных микроорганизмов. Абсорбируясь мукопептидом клеточной стенки, лизоцим расщепляет его с освобождением N-ацетилмурамовой кислоты и N-ацетилглю-козамина. Искажение структуры субстрата, поляризация гликозидной связи, образование водородной связи с кислородом последней приводят совместно к разрыву глюкозидной связи, а окружающая вода завершает акт гидролиза. Скорость реакции расщепления субстрата у разных лизоцимов различна, что, вероятно, связано с различием первичной структуры разных лизоцимов.
Лизоцим обнаружен в различных тканях и секретах: в сыворотке крови, слезах, слюне, молоке. Его максимальное количество содержится в лейкоцитах, затем в слюне и слезах, минимальное — в сыворотке крови. Почки денатурируют и разрушают плазменный лизоцим. В плазму крови лизоцим поступает при распаде лейкоцитов и тканей. Концентрация его зависит от соотношения между основными продуцентами — нейтрофилами и моноцитами и функции почек. Макрофаги высвобождают лизоцим постоянно, гранулоциты — только при дегрануляции, поэтому сывороточный лизоцим может служить индикатором макрофагальной функции организма. Основываясь на антибактериальных свойствах лизоцима, большинство исследователей склонно рассматривать его как фактор неспецифического иммунитета. Кроме основного антибактериального действия лизоцим стимулирует естественную резистентность организма животного, что играет большую роль в предупреждении заболеваний и в благоприятном исходе инфекционного процесса.
СИСТЕМА НОРМАЛЬНЫХ КИЛЛЕРОВ
К лимфоидным клеткам, способным оказывать цитотоксическое действие без сенсибилизации, относятся NK-клетки (естественные киллеры), которые в отличие от К-клеток могут проявлять цитотоксическое действие и в отсутствие специфических антител. Биологическое действие NK-клетки связано с контролем раннего опухолевого развития. NK-клетки обладают цитотоксической активностью по отношению к различным опухолевым клеткам, а также к клеткам, инфицированным вирусными или микробными агентами. Благодаря этому NK могут играть важную роль в устойчивости организма ко многим заболеваниям.
Взаимодействие антиген- антитело. Комплементарные, т. е. взаимно соответствующие друг другу антиген и антитела образуют иммунный комплекс антиген — антитело. Прочность таких структур определяют высокая избирательность и большая площадь взаимодействия на уровне атомных группировок или зарядов по принципу «ключ — замок». Взаимодействие осуществляется благодаря гидрофобным водородным электростатическим связям и силам Ван-дер-Ваальса. Антиген при этом соединяется своей антигенной детерминантой, антитело — своим активным центром. При избытке антигенов или антител образуются растворимые комплексы, при эквивалентном соотношении — нерастворимый преципитат.
Антиген, как правило, крупнее молекулы антитела, поэтому последняя может распознавать только отдельные участки антигена, которые называют детерминантами. Большинство антигенов имеет на поверхности целый набор различных антигенных детерминант, каждая из которых стимулирует иммунный ответ. Не все они одинаковы по активности: одни более иммуногенны и реакция на них доминирует в общем ответе. Даже одиночная детерминанта активирует, как правило, разные клоны клеток с поверхностными рецепторами (антителами), которые обладают разным сродством к данной детерминанте. Следовательно, иммунный ответ на большинство антигенов является поликлональным. Вместе с тем образовавшиеся антитела могут вступать в реакцию не только с гомологичным антигеном, но и с родственными ему гетерологичными антигенами.
Реакции неспецифического взаимодействия антител сыворотки крови с антигенами проявляются в следующих формах: агглютинация — склеивание антигенных частиц между собой; преципитация — агрегация частиц с образованием нерастворимых комплексов; лизис — растворение клеток под влиянием антител в присутствии комплемента; цитотоксичностъ — гибель клеток под влиянием антител — цитотоксинов; нейтрализация — обезвреживание токсинов белковой природы; опсонизация — усиление фагоцитарной активности нейтрофилов и макрофагов под влиянием антител или комплемента.
Обычный иммунный ответ выявляется через несколько суток после связывания антигена с В-лимфоцитом. Он представляет собой интегральную реакцию организма на антиген вследствие сложных взаимодействий между клетками разных типов.
8. РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА
Тимус и структуры нейроэндокринной системы взаимосвязаны между собой. В экспериментах отмечено, что активность гормонов тимуса находится под модулирующим влиянием эпифиза, гипофиза, коркового вещества надпочечников и гонад. В свою очередь, тимус также действует на их функции.
Тимус и гормоны коркового вещества надпочечников. Гормоны коркового вещества надпочечников обеспечивают распределение тимических факторов, регулируя их продукцию и реализацию. Кортикостерон и дезоксикортикостерона ацетат (ДОКА) увеличивают содержание тимических факторов в тимусе, селезенке и костном мозге. Альдостерон оказывает дифференцированное влияние на уровень гормонов тимуса, повышая его в этом органе и снижая в селезенке и лимфатических узлах. Нормальное распределение гормонов тимуса между тимусом, селезенкой и лимфатическими узлами 3:2:1. При отсутствии надпочечников восстанавливается только комплексной заместительной терапией при одновременном введении кортикостерона, ДОКА и альдостерона. При гиперфункции тимуса корковое вещество надпочечников сморщивается, а содержание аскорбиновой кислоты увеличивается.
Тимус и половые гормоны. Тимус непосредственно вовлечен в метаболизм стероидных гормонов, и в первую очередь половых. Одним из направлений активного метаболизма стероидных гормонов в тимусе является превращение прогестерона в 20а-гидроксипрегнандиол. Гормоны вилочковой железы изменяют синтез половых гормонов. Так, (βз-тимозин стимулирует секрецию лютеинизирующего гормона гипофиза, влияя на уровень экстрогенов. На эпителиальных клетках тимуса и Т-лимфоцитах имеются рецепторы к эстрогенам, андрогенам и прогестерону, при помощи которых они регулируют реализацию гормонов тимуса и дифференцировку тимоцитов
. Тимус и гормоны щитовидной железы. В контроле эндокринной функции эпителиальных клеток тимуса участвуют гормоны щитовидной железы, на которых имеются рецепторы к тироксину. Тироксин модулирует эффект и содержание тимических гормонов внутри тимуса. Инъекции тироксина восстанавливают уровень циркулирующего тимического фактора у старых животных.
Тимус и гормоны гипофиза. В поддержании нормального состояния внутритимического микроокружения важную роль играют гормоны гипофиза. После удаления гипофиза наступает быстрая инволюция тимуса, которая по гистологической картине аналогична возрастной. Гормон роста и тиреотропный гормон стимулируют как продукцию, так и реализацию гормонов тимуса и восстанавливают их нормальное распределение в организме. Приведенные выше данные позволяют считать, что тимус не обладает автономией, он является неотрывной взаимозависимой частью эндокринной системы организма.
Способность клеток лимфоидных органов продуцировать антитела при отсутствии каких-либо нейроэндокринных регуляторных сигналов вовсе не свидетельствует о том, что иммунная система функционирует вне интеграции с другими физиологическими системами. В настоящее время накоплен материал, доказывающий взаимодействие иммунной и нейроэндокринной систем. На клетках иммунной системы имеются рецепторы к таким гормонам и биологически активным веществам, как кортикостероиды, инсулин, гормон роста, тестостерон, эстрадиол, ацетилхолин, энкефалины, эндофины и др. Известно, что интерлейкины в ЦНС могут выполнять функцию нейромедиаторов. Это хорошо показано в отношении IL-1 и, по-видимому, справедливо и в отношении IL-2, IL-3 и IL-6. Так, IL-2 не только продуцируется клетками нервной ткани, но и влияет на пролиферацию и созревание элементов олигодендроглии.
Усиление иммунного ответа может быть получено и в результате денервации селезенки, которая, так же как и другие органы иммунной системы, имеет автономную иннервацию и содержит чувствительные нейроны.
Хорошо изучено влияние на состояние иммунной системы стресса и циркадных ритмов. Так, сильный стресс может индуцировать состояние транзиторного иммунодефицита. Такие изменения можно наблюдать у животных при выраженных стрессовых нагрузках. При этом происходят снижение активности МК-клеток, уменьшение содержания IgA в слюне, подавление пролиферативного ответа лимфоцитов на антигены и угнетение функций неспецифического иммунитета.
В то же время стрессовые факторы средней интенсивности (умеренные физические нагрузки) повышают резистентность организма к инфекции. Это хорошо согласуется с принятыми понятиями, что направленность действия глюкокортикоидов на иммунные реакции зависит от концентрации лих гормонов: высокие концентрации оказывают иммунодепрессивное действие, а низкие — иммуностимулирующее.
